واکنش پودر آلومینیوم
واکنش پودر آلومینیوم به دلیل سطح فعال بالا و طبیعت شیمیایی فلز آلومینیوم، بسیار متنوع و گاه شدید هستند. این واکنش ها در صنایع مختلف (از متالورژی تا مواد منفجره) اهمیت ویژهای دارند.
مهمترین واکنش پودر آلومینیوم توضیح داده شده اند:
۱. واکنش با اکسیژن (اکسیداسیون)
- آلومینیوم در تماس با هوا به سرعت با اکسیژن واکنش داده و لایه اکسید آلومینیوم (Al₂O₃) تشکیل می دهد:
- 4Al+3O2→2Al2O3
- این لایه اکسید، غیرفعال و محافظ است و از خوردگی بیشتر جلوگیری می کند.
- در دماهای بالا (مثلاً در احتراق)، این واکنش شدیدتر است و نور سفید درخشان و گرمای زیادی آزاد می کند.
۲. واکنش با آب
- آلومینیوم معمولاً با آب سرد واکنش نمی دهد (به دلیل لایه اکسید محافظ).
- در صورت آسیب لایه اکسید (مثلاً در محیط اسیدی یا بازی) یا در آب داغ/بخار، واکنش زیر رخ می دهد:
- 2Al+6H2O→2Al(OH)3+3H2↑
- تولید گاز هیدروژن قابل اشتعال!
- این واکنش در تولید هیدروژن یا سوخت های پاک مورد مطالعه است.
۳. واکنش با اسیدها
- آلومینیوم با اسیدهای رقیق (مانند HCl یا H₂SO₄) واکنش داده و گاز هیدروژن آزاد می کند:
- 2Al+6HCl→2AlCl3+3H2↑
- 2Al+3H2SO4→Al2(SO4)3+3H2↑
- در اسیدهای غلیظ یا اکسیدکننده (مانند HNO₃ غلیظ)، ممکن است لایه اکسید پایدارتر شود و واکنش متوقف گردد (پسیواسیون).
۴. واکنش با بازها
- آلومینیوم در محیط های قلیایی (مانند NaOH) به شدت واکنش می دهد:
- 2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
- این واکنش در صنعت برای حذف آلومینیوم از ضایعات یا تولید هیدروژن استفاده می شود.
۵. واکنش احتراق (سوختن)
- پودر آلومینیوم به راحتی در هوا می سوزد و نور سفید درخشان و گرمای شدید تولید می کند:
- 4Al+3O2→2Al2O3+انرژی
- این ویژگی در آتش بازی، مواد منفجره (مانند TNT + Al)، و سوخت موشک کاربرد دارد.
۶. واکنش ترمو شیمیایی (ترمیت)
- مخلوط پودر آلومینیوم و اکسید فلزی (مانند آهن اکسید) با جرقه، واکنش شدیدی موسوم به واکنش ترمیت نشان می دهد:
- Fe2O3+2Al→2Fe+Al2O3+گرمای شدید ( 2500°C)
- کاربرد: جوشکاری ریل ها، تولید فلزات مذاب، و نظامی.
۷. واکنش با هالوژن ها
- آلومینیوم با کلر، برم، یا ید واکنش داده و هالیدهای آلومینیوم تشکیل می دهد:
- 2Al+3Cl2→2AlCl3
- این واکنشها بسیار گرمازا و گاه انفجاری هستند.
۸. واکنش با نیتروژن
- در دماهای بسیار بالا (بالای 800°C)، آلومینیوم با نیتروژن واکنش می دهد:
- 2Al+N2→2AlN
- آلومینیوم نیترید (AlN) در صنایع الکترونیک به عنوان عایق حرارتی استفاده می شود.
۹. واکنش در محیط نمکی
در حضور یون های کلرید (مانند آب دریا)، لایه اکسید آلومینیوم تخریب شده و خوردگی موضعی (حفره دار شدن) رخ می دهد.
کاربرد کلیدی واکنش های پودر آلومینیوم:
- مواد منفجره و آتش بازی: به عنوان ماده اکسید شونده و تولیدکننده نور.
- تولید هیدروژن: برای سوخت های پاک یا باتری ها.
- جوشکاری ترمیت: اتصال ریل های فولادی.
- کاتالیزور: در برخی فرایندهای شیمیایی.
ملاحظات ایمنی
- پودر آلومینیوم به شدت قابل اشتعال است و در تماس با هوا ممکن است انفجار گرد و غبار ایجاد کند.
- واکنشهای آن با آب یا اسیدها، گاز هیدروژن قابل اشتعال آزاد می کند.
- در حین کار با پودر آلومینیوم، استفاده از تجهیزات ضد جرقه و محیط های کنترل شده ضروری است.
در مجموع، واکنش پذیری بالای پودر آلومینیوم، آن را به ماده ای کلیدی در صنایع شیمیایی، متالورژی، و نظامی تبدیل کرده است، اما نیاز به مدیریت دقیق ایمنی دارد.
پرکاربردترین واکنشهای پودر آلومینیوم در صنعت به دلیل واکنش پذیری بالا، گرمازایی شدید، و قابلیت کاهش دهندگی قوی این ماده، در حوزه های مختلفی مانند متالورژی، مواد منفجره، انرژی، و شیمیایی استفاده می شوند. در زیر مهمترین این واکنشها به همراه کاربردهای صنعتی آنها آورده شده است:
پرکاربردترین واکنش های پودر آلومینیوم در صنعت
۱. واکنش ترمیت (Thermite Reaction)
- Fe2O3+2Al→2Fe+Al2O3+گرمای شدید ( ۲۵۰۰°C)
کاربرد صنعتی:
- جوشکاری ریل های راه آهن، لوله های فولادی، و تعمیر تجهیزات سنگین.
- تولید فلزات مذاب در شرایط اضطراری (مانند جوشکاری در محل بدون برق).
- در صنایع نظامی برای ساخت مواد منفجره و گلوله های آتش زا.
۲. احتراق پودر آلومینیوم (Combustion)
- 4Al+3O2→2Al2O3+انرژی (نور و گرما)
کاربرد صنعتی:
- مواد آتش بازی: ایجاد نور سفید درخشان در فشفشه ها و موشک های نمایشی.
- سوخت جامد موشک ها: به عنوان ماده اکسید شونده در ترکیب با پرکلرات آمونیوم (مثلاً در بوسترهای شاتل فضایی).
- مواد منفجره: افزودن پودر Al به TNT یا ناپالم برای افزایش قدرت انفجار.
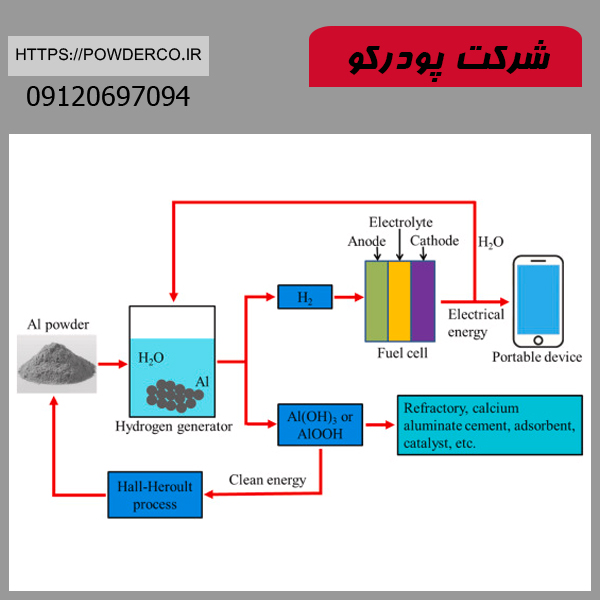
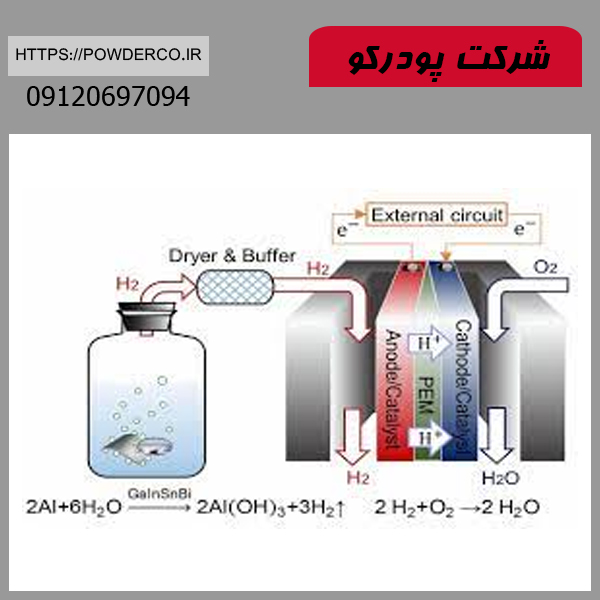
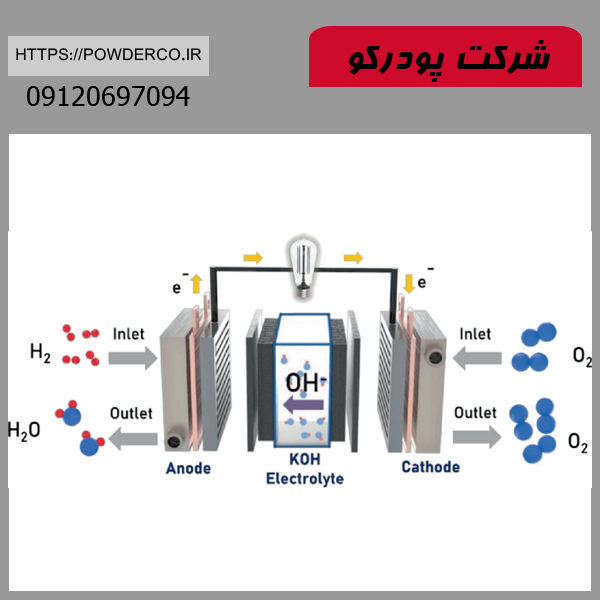
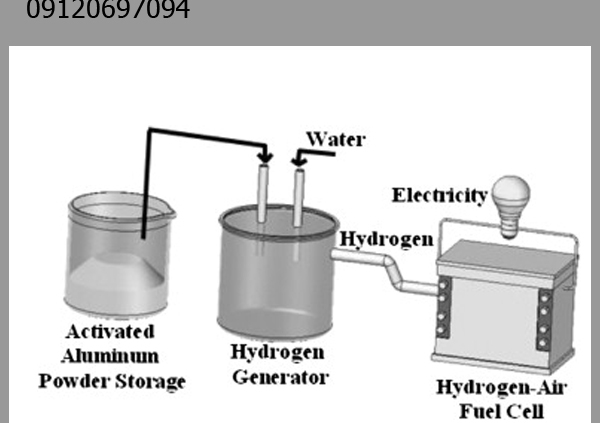
۳. واکنش با آب و تولید هیدروژن
- 2Al+6H2O→2Al(OH)3+3H2↑
کاربرد صنعتی:
- تولید هیدروژن سبز: به عنوان یک روش جایگزین برای تولید سوخت پاک (در حال تحقیق).
- باتری های آلومینیوم-هوا: استفاده در سیستم های ذخیره انرژی با چگالی بالا.
- پاکسازی ضایعات آلومینیومی: حل کردن ضایعات در محیطهای آبی قلیایی.
۴. واکنش با اسیدها (تولید نمک و گاز هیدروژن)
- 2Al+6HCl→2AlCl3+3H2↑
کاربرد صنعتی:
- تولید آلومینیوم کلرید (AlCl₃): کاتالیزور در صنایع پتروشیمی (مانند تولید بنزین).
- حذف آلودگیهای سطحی: اسیدشویی قطعات آلومینیومی در صنایع خودروسازی.
۵. واکنش با بازها (تولید آلومینات و هیدروژن)
- 2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
کاربرد صنعتی:
- بازیافت آلومینیوم از ضایعات (مانند قوطی های نوشابه).
- تولید سدیم آلومینات برای تصفیه آب و فاضلاب.
۶. واکنش اکسیداسیون سطحی (تشکیل Al₂O₃)
- 4Al+3O2→2Al2O3
کاربرد صنعتی:
- ایجاد لایه محافظ اکسیدی روی قطعات آلومینیومی برای جلوگیری از خوردگی.
- تولید سرامیک های پیشرفته (Al₂O₃) در صنایع الکترونیک و پزشکی.
۷. واکنش در فرایندهای احیاء فلزات (Reduction)
پودر Al به عنوان یک کاهنده قوی در استخراج فلزات گرانبها استفاده میشود:
- 3MnO2+4Al→3Mn+2Al2O3
کاربرد صنعتی:
- احیای اکسیدهای فلزی مانند کروم، مولیبدن، و تیتانیوم.
- تولید فروآلیاژها در صنایع فولادسازی.
۸. واکنش با نیتروژن (تشکیل آلومینیوم نیترید)
- 2Al+N2→800°C2AlN
کاربرد صنعتی:
تولید آلومینیوم نیترید (AlN): عایق حرارتی با رسانایی الکتریکی پایین در تراشه های الکترونیکی.
۹. واکنش با هالوژن ها (تشکیل هالیدهای آلومینیوم)
- 2Al+3Cl2→2AlCl3
کاربرد صنعتی:
- تولید آلومینیوم کلرید برای کاتالیزورهای شیمیایی (مثلاً در سنتز داروها).
- استفاده در فرایندهای تصفیه نفت خام.
۱۰. واکنش در کامپوزیتهای پیشرفته
- پودر Al با مواد دیگری مانند سرامیکها یا پلیمرها ترکیب میشود تا کامپوزیتهای سبک و مستحکم بسازد.
کاربرد صنعتی:
- ساخت قطعات هوافضا و خودرو با نسبت استحکام به وزن بالا.
ملاحظات ایمنی:
- پودر آلومینیوم در صورت تماس با رطوبت یا گرما، گاز هیدروژن قابل اشتعال تولید می کند.
- ذرات ریز Al در هوا ممکن است باعث انفجار گرد و غبار شوند.
- در واکنشهای گرمازا (مانند ترمیت)، تجهیزات ضدحریق و کنترل دما ضروری است.
جمع بندی
واکنشهای پودر آلومینیوم در صنعت، از جوشکاری ریل ها تا تولید هیدروژن و ساخت مواد منفجره، نقش کلیدی ایفا می کنند. این ماده به دلیل هزینه پایین، دسترسی آسان، و واکنش پذیری بالا، یک جزء اساسی در فناوری های پیشرفته محسوب میشود.



دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.